Détermination de la structure d’une subtilase autotransporteur : Vers une meilleure compréhension des protéases bactériennes du tractus gastro-intestinal et des écosystèmes alimentaires
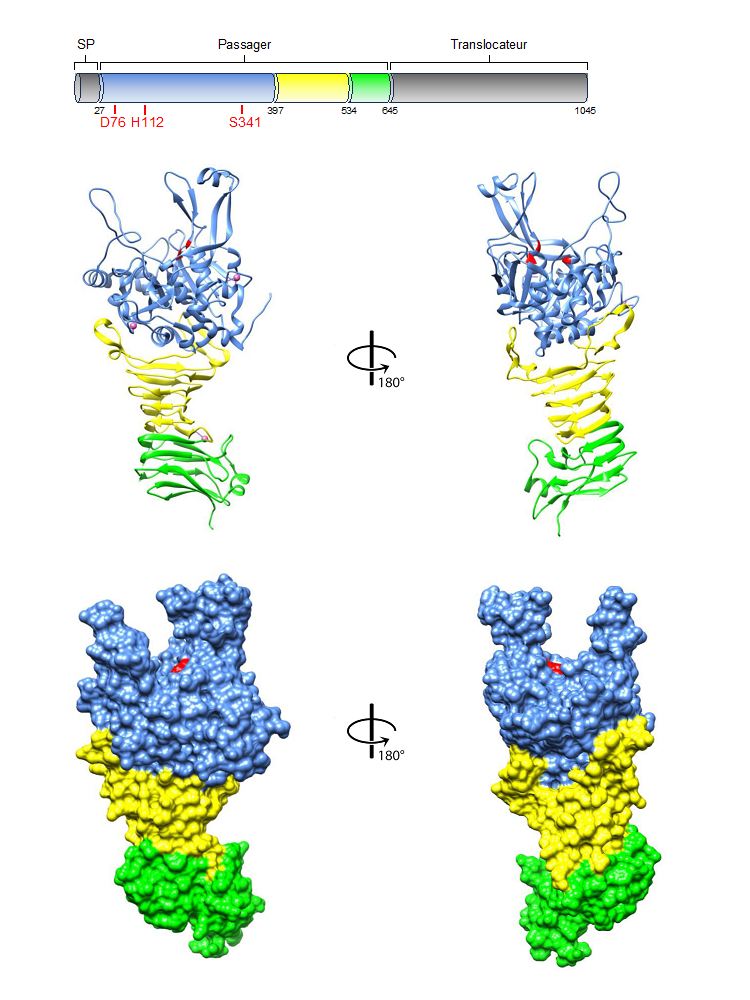
Dans le cadre d’une collaboration avec The Institute for Molecular Science, La Trobe University (Australie) et l’UMR MEDIS, une nouvelle structure de protéase bactérienne appartenant à la famille des SATs (subtilase autotransporters) a été publiée dans le journal Nature Communications, ce travail contribuant à une meilleure compréhension du rôle des protéases bactériennes dans le tractus gastro-intestinal animal, humain ou d’autres écosystèmes de la chaîne alimentaire.
Au niveau du tractus gastro-intestinal (TGI), de nombreuses protéases interviennent dans la dégradation des protéines alimentaires mais aussi dans la réponse immunitaire. Tandis que le rôle des protéases humaines dans le maintien de l'homéostasie du TGI est bien connu, les protéases bactériennes peuvent aussi intervenir dans différents types d’interactions microbiennes et contribuer au développement d’états physiopathologiques, notamment lors d’infections par des pathogènes. Les bactéries peuvent sécréter une grande variété de protéases, notamment de la famille des autotransporteurs (ATs) chez les bactéries à Gram négatif. Sur les deux grandes familles de protéases empruntant le système de sécrétion de type V (T5SS), nos connaissances sur les subtilases restent lacunaires.
En prenant Ssp (Serratia serine protease) comme modèle de SAT (subtilase autotransporter), la détermination de sa structure tridimensionnelle a révélé une architecture originale et distincte des autres ATs. La triade catalytique est située dans une poche au sommet de l'AT, le domaine catalytique N-terminal de type subtilase étant positionné directement au-dessus d'un domaine C-terminal β-hélicoïdal. La structure de Ssp est stabilisée par trois sites de liaison au calcium et possède un domaine autochaperon impliqué dans son repliement. Comme indiqué par des analyses génétiques fonctionnelles, les trois protubérances entourant le site actif sont impliquées dans la reconnaissance et la liaison au substrat ainsi que la cible cellulaire, et par conséquence dans l’activité cytotoxique de Ssp, mais ne sont pour autant pas nécessaires à son internalisation.
La détermination de la structure de Ssp représente une avancée significative dans la compréhension de l’activité des SATs, notamment par rapport à l’autre grande famille de protéases chez les ATs, les SPATEs (serine protease ATs of Enterobactericeae). En plus des mécanismes moléculaires sous-jacents à la divergence fonctionnelle des ATs, ces travaux s’inscrivent vers une meilleure compréhension du rôle et de la contribution respective des diverses protéases bactériennes dans le TGI animal, humain ou d’autres écosystèmes de la chaîne alimentaire.
Référence de la publication :
Hor L, Pilapitiya A, McKenna JA, Panjikar S, Anderson MA, Desvaux M, Paxman JJ, Heras B. 2023. Crystal structure of a subtilisin-like autotransporter passenger domain reveals insights into its cytotoxic function. Nature Communications. 14:1163. https://doi.org/10.1038/s41467-023-36719-2
Coordonnées :
Mickaël Desvaux, UMR MEDIS (Microbiologie Environnement Digestif, Santé), INRAE-UCA, Clermont-Ferrand, France
Mél : mickael.desvaux@inrae.fr
