Le syndrome ou complexe de Carney (CNC) est un syndrome héréditaire multi-néoplasique très rare (800 cas) alliant la survenue de tâches pigmentées de la peau et une prédisposition à diverses tumeurs endocrines (glandes surrénale, thyroïde, hypophyse et gonades) et non endocrines (myxomes cardiaques, mammaires, cutanées, osseux…). A côté des atteintes endocrines conduisant à des hypersécrétions hormonales très invalidantes, la manifestation clinique la plus fréquemment observée chez les patients est une pigmentation anormale de la peau allant de la présence de lentigines "taches de rousseur" en des localisations inhabituelles (dont les muqueuses oculaire, buccale et génitale) jusqu’au nævus bleu ou au myxome. Contrairement aux atteintes endocrines, et bien que très caractéristiques de cette maladie, l’origine des lésions cutanées est complètement inexpliquée.
Des mutations d’une sous unité régulatrice (PRKAR1A) de la Protéine Kinase A (PKA) sont retrouvées dans le CNC et sont responsables d’une activation constitutive de cette signalisation cellulaire. Les scientifiques ont développé un modèle animal reproduisant les atteintes surrénaliennes et gonadiques chez la souris en invalidant le gène Prkar1a, spécifiquement dans les cellules stéroïdogènes (fabriquant les hormones stéroïdes : glucocorticoïdes, androgènes, oestrogènes …) de ces organes. Outre les lésions surrénaliennes et gonadiques attendues, ces souris mutantes présentent des défauts de pigmentation sur des zones de la peau rappelant ceux des patients.
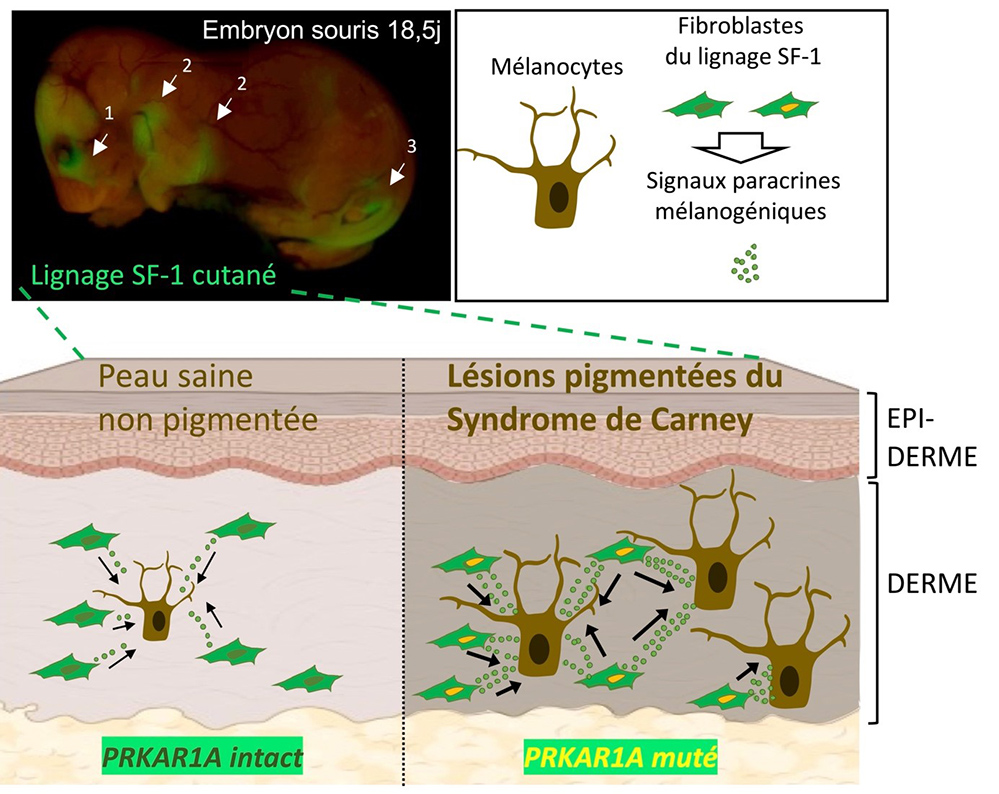
Les analyses immunohistologiques et moléculaires, les cultures de derme ainsi que le suivi des lignages cellulaires portant la mutation du gène au cours de l’embryogenèse des souris, ont montré que l’hyperpigmentation était associée à un nombre élevé de mélanocytes (cellules produisant la mélanine) dermiques dans les muqueuses incriminées. Cependant, les cellules mutantes ne sont pas des mélanocytes mais des fibroblastes dermiques capables d’induire sous l’influence de la mutation, des signaux paracrines stimulant la prolifération et l’activité des mélanocytes voisins. Enfin, grâce à des biopsies de patients fournies par leurs collaborateurs étasuniens, les scientifiques ont pu démontrer que ces mécanismes identifiés dans le modèle animal étaient en partie transposable à l’Homme.
Ces travaux proposent pour la première fois une origine plausible aux lésions cutanées du CNC qui seraient le résultat d’une activité pro-mélanogénique excessive d’une nouvelle population de fibroblastes dermiques partageant des précurseurs embryonnaires communs avec les cellules stéroïdogènes. Enfin, ces populations cellulaires accompagnent le développement embryonnaire et périnatal des organes génitaux externes et de la glande mammaire, suggérant que dans un contexte physiologique elles pourraient participer à la maturation des fonctions de reproduction.
© Antoine Martinez & Isabelle Sahut-Barnola
Figure : Découverte de zones cutanées spécifiquement associées aux régions céphalique (1), mammaire (2) et génitale (3). Ces zones cutanées sont caractérisées par l’origine stéroïdogène (lignage cellulaire SF-1) des fibroblastes composant le derme. Chez les souris mutantes pour le gène Prkar1a (comme chez les patients souffrant du syndrome de Carney), ces zones sont la cible de lésions dermiques hyperpigmentées qui s’expliquent par les sécrétions paracrines accrues des fibroblastes portant la mutation, favorisant ainsi la prolifération et l’activité des mélanocytes voisins.


